12 функций белков в организме
Зачем организму белок? Проверьте, все ли функции белков вы знаете.


Из этой статьи вы узнаете:
- что такое белок;
- какие виды белков существуют;
- сколько белков в организме;
- какие функции выполняют белки;
- можно ли создать новые белки в лаборатории.
Мы завели телеграм-канал «Ты как?». Будем в удобном формате рассказывать о саморазвитии, психологии и о том, как эффективно учиться и строить карьеру в любом возрасте. Подписывайтесь!
Что такое белок
Белок — это, без преувеличения, «молекула жизни». Отправляя космический зонд в поисках жизни на Марсе, спутниках Юпитера и Сатурна, ученые NASA дают ему задание найти не только воду, но и аминокислоты — строительный материал для белковой молекулы [1]. При их обнаружении можно будет сделать вывод, что жизнь на планете есть или существовала ранее.
Если разобрать любой белок, мы получим в среднем 300 аминокислот [2]. Аминокислоты выступают в роли «деталей», из которых можно создать неограниченное количество «конструкций» — белков [3]. Хотя аминокислот всего 20, но их последовательность и количество уникальны в каждом белке [3].
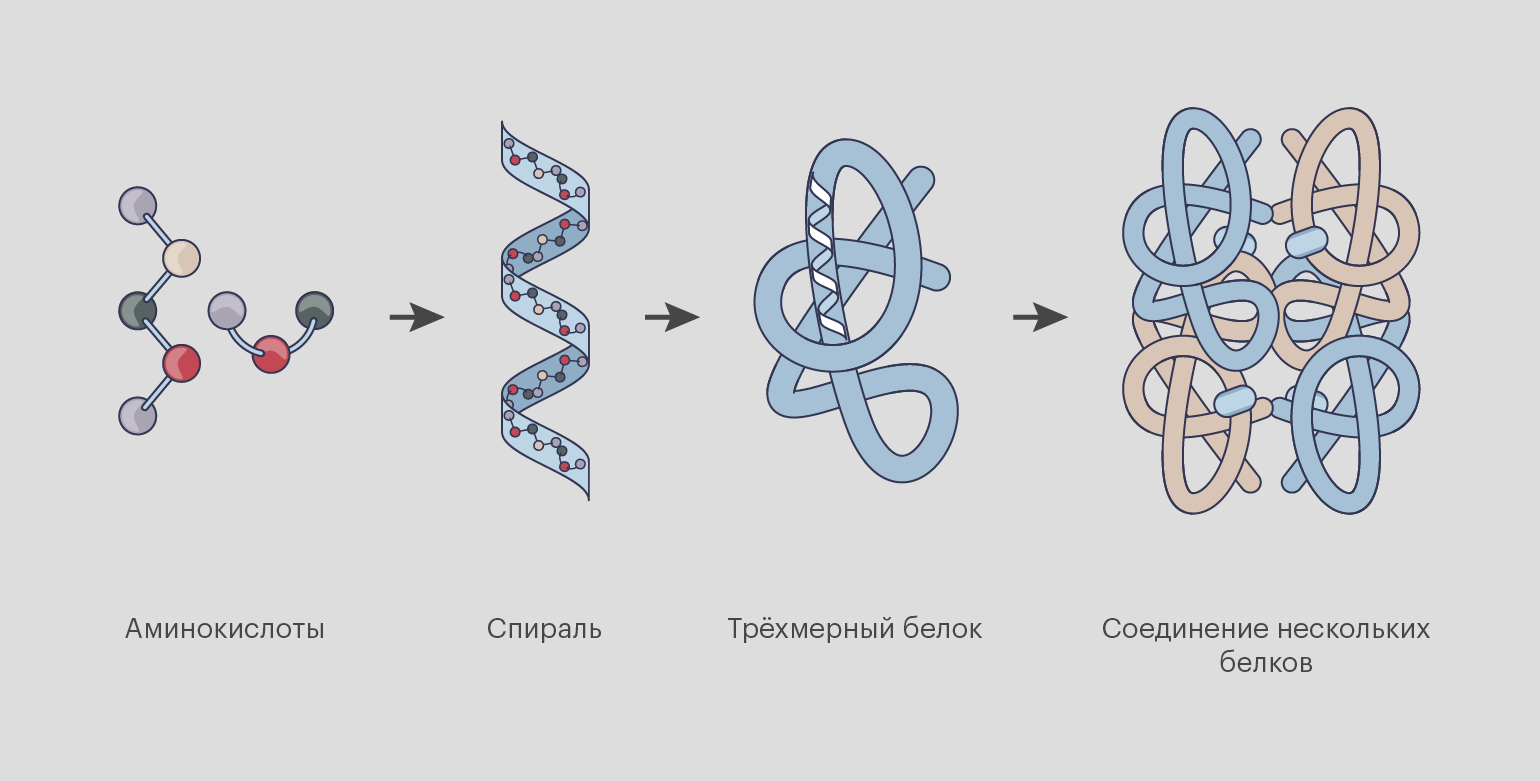
Как образуется белок [4]:
- Сначала аминокислоты выстраиваются в длинные цепочки — пептиды.
- Они складываются в виде гармошки и образуют спираль.
- Несколько таких спиралей скручиваются в компактный трёхмерный белок.
- Несколько белков могут объединиться и создать новую молекулу.
Белки и протеины — это одно и то же?
Да. В отечественной литературе название «белок» появилось потому, что первые опыты по выделению молекул проводили на яичном белке [5]. Но в мировой науке для их обозначения используют термин «протеин», который ввёл шведский учёный Йёнс Якоб Берцелиус в 1838 году: на греческом prōteios значит «первый по значимости».

Изображение: ÖNB Digital
Виды белков
С точки зрения химического состава белки классифицируются как простые и сложные. Простые белки состоят исключительно из цепочек аминокислот. Сложные, помимо аминокислот, содержат дополнительные небелковые компоненты [6].
Кстати, из названия протеина можно понять, какая его часть дополнительная, например:
- металлопротеины содержат ионы металлов;
- хромопротеины включают пигмент;
- липопротеины представляют собой связку «белок + жир».
Сколько всего белков в организме
Изучением белков занимается отдельная наука — протеомика [7]. В 2001 году по инициативе международного сообщества учёных была создана Организация по изучению протеома человека — Human Proteome Organization, или HUPO [8]. Её основная задача — создать полный перечень белков в организме человека, разработать молекулярный атлас протеинов для каждого органа и каждой ткани. Это позволит понять, как все протеины взаимодействуют друг с другом и какие белки могут появляться при патологиях.
По состоянию на апрель 2023 года HUPO уже определила:
- В человеческом геноме присутствует около 19 778 белков.
- 18 397, или 93,01%, уже идентифицированы.
- Остальные 1381 называют недостающими — missing protein [8].
Но важно уточнить, что 19 778 — это не общее количество белков в организме, а количество различных типов белков, закодированных в геноме человека. То есть один и тот же ген может создавать разные формы протеинов, после этого они видоизменяются — присоединяют к себе другие вещества и превращаются в более сложные соединения [9].
Какие функции у белков организме
Функция белкового вещества зависит от его формы [2]. Как только белок приобретает свою форму, он может связываться с другими молекулами, чтобы выполнить одну из следующих функций.
 Транспорт веществ
Транспорт веществ
Белки связывают и переносят вещества из одних тканей в другие или из межклеточного пространства в клетку. Самые известные транспортные белки:
- Липопротеиды — участвуют в транспорте жиров: холестерина и триглицеридов. Одни липопротеиды доставляют жир из печени в клетки, другие «вылавливают» холестерин из крови и передают клеткам печени. Первые называют «плохим» холестерином, вторые — «хорошим» [10].
- Трансферрин — транспортирует ионы железа, причем может переносить на своей поверхности больше железа, чем весит сам [10].
- Альбумин — составляет больше половины белков крови. Альбумины переносят гормоны, лекарства, желчные кислоты, витамины, некоторые микроэлементы, например цинк. Также альбумины могут связывать тяжелые металлы и токсины, чтобы те не навредили организму [7].

Читайте также:
 Дыхание
Дыхание
Помимо дыхания в лёгких, существует ещё тканевое дыхание: ткани поглощают кислород и отдают накопившийся в них углекислый газ. Чтобы этот обмен произошел, необходимы «дыхательные» белки — гемоглобин и миоглобин.
Гемоглобин — белок красных клеток крови, который присоединяет к себе кислород или углекислый газ [11].
Миоглобин — в крови практически отсутствует, зато сконцентрирован в мышцах и придаёт им красный цвет [12]. Если гемоглобин легко отдаёт и присоединяет кислород, то миоглобин «запрограммирован» удерживать кислород, пока в нём не возникнет острая необходимость [13]. Такая «аварийная» ситуация возникает, когда нужно больше кислорода, чем доставляет гемоглобин. Например, когда мы активно двигаемся, мелкие сосуды, питающие мышцу, сдавливаются при мышечном сокращении, и миоглобин остается единственным источником кислорода [13].
 Защита организма
Защита организма
У иммунной системы нет точного «адреса» в организме. Это множество клеток и белковых молекул в составе крови и внутри тканей. Главные защитные белки — это антитела, или иммуноглобулины. У этих молекул своеобразная форма в виде буквы Y. Благодаря ей антитела могут связывать чужеродные белки, чтобы они не навредили организму [14].
На поверхности иммуноглобулинов есть углубления разной формы. Они на 100% соответствуют очертаниям антигена — молекулы, против которой действуют антитела. Присутствие таких антител против возбудителя какой-либо болезни называют приобретённым иммунитетом.

Читайте также:
 Работа органов чувств
Работа органов чувств
Зрение, слух, обоняние, вкус и осязание начинаются с чувствительных нервных окончаний — рецепторов [15]. Все они представляют собой специализированные белки разной формы, которые реагируют строго на определённый стимул:
- фоторецепторы — на световые волны;
- механорецепторы — на давление или звуковую волну;
- терморецепторы — на холод или тепло;
- хеморецепторы — на растворённые молекулы сахара и кислот или летучие ароматические соединения [15].
 Остановка кровотечения
Остановка кровотечения
За это отвечают множество белков, которые называют факторами свёртывания. Они растворены в крови, но в неактивной форме. Как только сосудистая стенка повреждается, факторы свёртывания активируются один за другим. В финале этой цепной реакции образуется фибрин — плотный нерастворимый белок, который формирует прочную трёхмерную сеть. На ней фиксируются клетки крови и постепенно формируется прочный тромб, «запечатывающий» повреждённый участок сосуда [16].
 Движение
Движение
Сокращение мышц обеспечивается взаимодействием двух нитевидных двух белков — миозина и актина. Они расположены параллельно друг другу, и когда актин скользит по миозину, мышца сокращается [17].
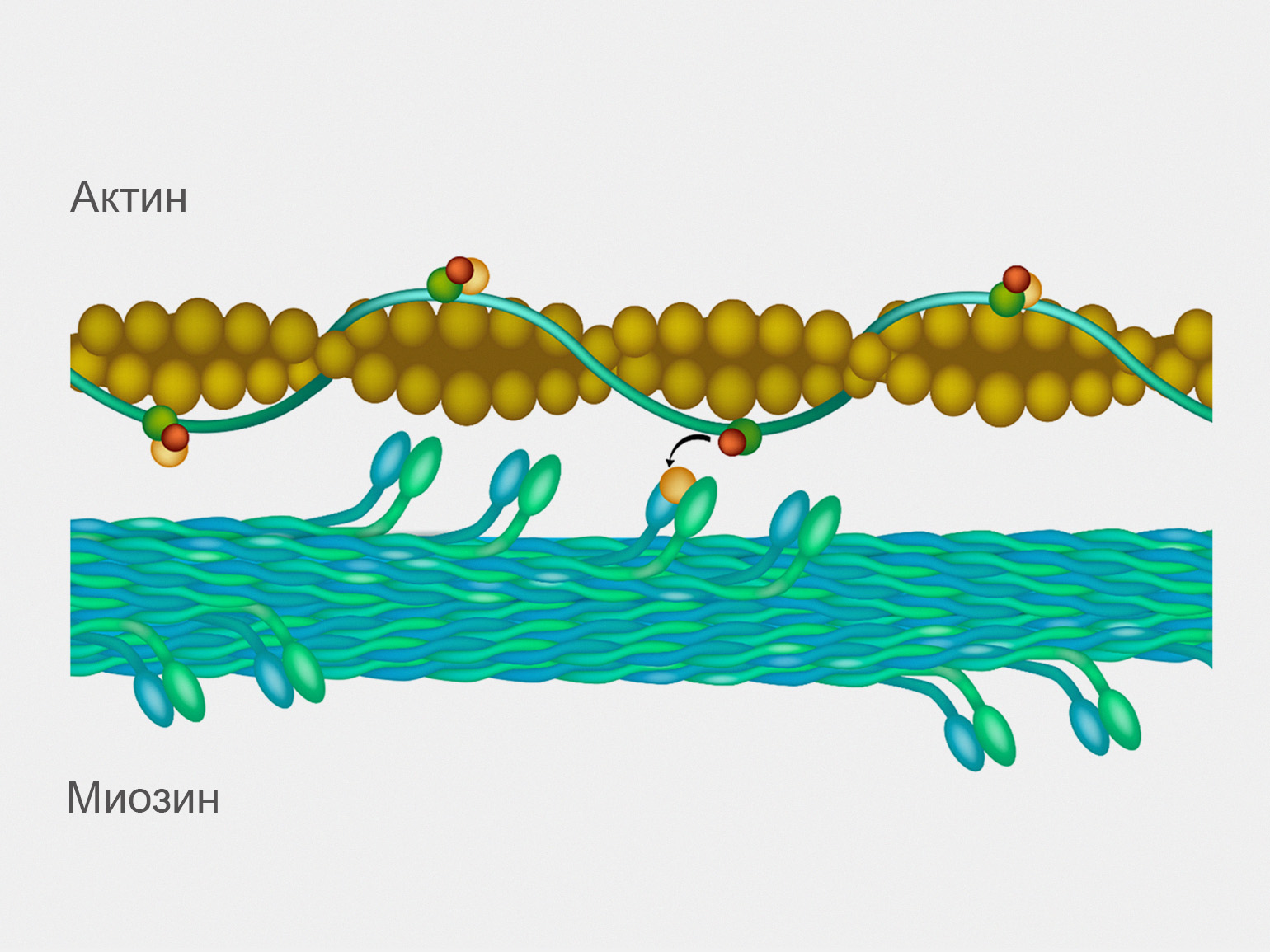
Около 40% массы тела взрослого здорового человека весом около 70 килограммов составляют мышцы, которые примерно на 20% состоят из мышечного белка. Таким образом, в организме человека содержится от 5 до 6 килограммов мышечного белка [18].
 Обмен веществ
Обмен веществ
Обмен веществ протекает, даже когда вы не двигаетесь или спите. Сложные молекулы расщепляются до простых, из простых создаются новые сложные, вредные вещества нейтрализуются, а полезные сохраняются. Все эти процессы происходят при участии ферментов, которые ускоряют химические реакции.
Ферменты — это белковые молекулы, каждая из которых действует строго избирательно. Название фермента всегда заканчивается на «-аза», а в начале содержит «краткую справку» о веществе, на которое действует, и даже самой реакции [10]. Например:
- Алкогольдегидрогеназа — работает в печени и нейтрализует алкоголь. «Дегидро» означает, что фермент удаляет из молекулы этанола (алкоголя) водород [19].
- АТФ-синтаза — образует (синтезирует) молекулу АТФ, в виде которой клетки аккумулируют энергию. Есть еще АТФаза, которая, наоборот, разрушает АТФ, чтобы получить энергию [19].
- H+-K+-АТФаза — протонный «насос» в клетках желудка. Он «качает» ионы водорода (H+) в полость желудка в обмен на ионы K+. Ионы водорода вместе с ионами хлора создают в желудке кислую среду. Этот процесс очень энергозатратный, поэтому «насос» содержит АТФазу. Кстати, именно H+-K+-АТФаза — «мишень» для действия таких лекарств, как омепразол или пантопразол. Все препараты этой группы подавляют работу «насоса» и снижают кислотность желудка [20].

Читайте также:
 Пищеварение
Пищеварение
Организм не может усвоить пищу в том виде, в каком мы её употребляем. Но в пищеварительной системе есть ферменты для обработки белков, жиров и углеводов:
- Амилаза — присутствует в слюне и соке поджелудочной железы для превращения сложного углевода крахмала в простую глюкозу.
- Липаза — расщепляет крупные молекулы жиров (триглицериды) на более простые компоненты: жирные кислоты и глицерин.
- Пепсин — действует в кислой среде желудка, помогает превратить белок в пептиды. Последние представляют собой цепочки чуть длиннее аминокислот [21].
Есть также ферменты для конкретных питательных веществ, например лактаза, которая нужна, чтобы расщепить лактозу — молочный сахар. У некоторых людей лактазы изначально очень мало, поэтому они не могут усвоить молочные продукты, — это расстройство называют непереносимостью [21].

Читайте также:
 Структура и опора
Структура и опора
Во всех тканях есть «каркас», который обеспечивает прочность органа и состоит из коллагеновых волокон. Коллаген — самый распространенный белок в организме. Больше всего коллагена в костях, сухожилиях, связках и коже [22].
 Гормональная регуляция
Гормональная регуляция
Некоторые гормоны по своей природе — белки. Например:
- Инсулин — помогает глюкозе проникнуть в клетку.
- Соматотропин — «гормон роста», стимулирует рост тканей.
- Тиреотропин — заставляет щитовидную железу выделять больше гормонов.
- Фолликулостимулирующий и лютеинизирующий — регулируют функцию яичников и менструальный цикл.
- Окситоцин — запускает роды [23].
 Хранение
Хранение
Есть так называемые «запасающие» белки, способные хранить минералы в организме. Например, железо в организме откладывается в виде ферритина. Это белок сферической формы, в центре которого могут поместиться до 4500 атомов железа [24].
 Энергия
Энергия
Белки — такие же «носители калорий», как углеводы или жиры. При расщеплении 1 грамма белка выделяется 4 ккал энергии, столько же образуется из 1 грамма углеводов. Но учитывая, сколько функций выполняют белковые соединения в организме, крайне нерационально использовать их для получения энергии, если есть углеводы и жиры. Поэтому белок — это резервный источник калорий. Организм решится использовать его, только если израсходованы другие «носители» — углеводы и жиры [25].

Читайте также:
Можно ли создать новый белок
Более полувека ученые не могли понять, в какой именно последовательности выстраиваются аминокислоты для создания белка. Речь не о случайном порядке, есть какая-то закономерность, которую, как считалось ранее, невозможно разгадать. Но в 2024 году научный мир узнал о работах Дэвида Бейкера, Демиса Хассабиса и Джона Джампера. За революционные достижения в области понимания и создания белков они получили Нобелевскую премию [26].

Дэвиду Бейкеру удалось придумать новый белок из аминокислот, используя технологию компьютерного дизайна. С тех пор его исследовательская группа разработала множество необычных белковых структур, включая белки, которые можно использовать в качестве лекарств, вакцин, наноматериалов и миниатюрных сенсоров.
Демис Хассабис и Джон Джампер разработали модель искусственного интеллекта, которая способна с высокой точностью предсказывать трёхмерную структуру белков по их аминокислотной последовательности [26]. Это значит, что теперь учёные смогут быстрее и эффективнее разрабатывать лекарства, затрачивая меньше усилий и средств. Возможно, именно благодаря этому открытию мир скоро получит доступные препараты для лечения заболеваний.
Источники
1. Life signs could survive near surfaces of Enceladus and Europa. NASA Science
2. Alberts B., Johnson A., Lewis J., et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002.
3. Koshland Daniel E., Haurowitz Felix. Protein: Secondary structure. Encyclopedia Britannica. 2025.
4. Nilsson B. L., Soellner M. B., Raines R. T. Chemical synthesis of proteins. Annu Rev Biophys Biomol Struct. 2005. 34. 91–118. DOI: 10.1146/annurev.biophys.34.040204.144700.
5. Липкин В. М., Шуваева Т. М. Белки (в биологии). Большая российская энциклопедия: научно-образовательный портал. 2023
6. Jain A., Jain R., Jain S. Protein Analysis in Food. In: Basic Techniques in Biochemistry, Microbiology and Molecular Biology. Springer Protocols Handbooks. Humana, New York, NY. 2020. DOI: 10.1007/978-1-4939-9861-6_41.
7. Шугалей И. В., Гарабаджиу А. В., Целинский И. В. Химия белка: учебное пособие. — СПб.: Проспект Науки, 2010. — 200 с.
Развернуть список
8. The Human Proteome Organization (HUPO).
9. Wang M., Zhang R., & Su D. How many proteins are there in humans. Chinese Science Bulletin. 2017. 62. 3256–3261. DOI: 10.1360/N972016-01016.
10. Емельянов В. В., Максимова Н. Е., Мочульская Н. Н. Биохимия: учеб. пособие. Екатеринбург: Издательство Уральского университета, 2016. 132 с.
11. Human Biochemistry by G. Litwack (2008). Table 14–4, page 889.
12. Trivedi D. J., Kulkarni S. P., Mudaraddi R. Primary Myoglobinuria: Differentiate Myoglobinuria from Hemoglobinuria. Indian J Clin Biochem. 2017 Jul. 32(3). 367–369. DOI: 10.1007/s12291-016-0607-4.
13. Агаджанян Н. А., Смирнов В. М. Нормальная физиология: Учебник. Москва: ООО «Издательство „Медицинское информационное агентство“», 2012.
14. Janeway C. A. Jr, Travers P., Walport M., et al. Immunobiology: The Immune System in Health and Disease. 5th edition. New York: Garland Science; 2001.
15. Ткачук В. А., Воротников А. В., Тюрин-Кузьмин П. А. Основы молекулярной эндокринологии. Рецепция и внутриклеточная сигнализация. Учебное пособие. Министерство образования и науки РФ. Москва: ГЭОТАР-Медиа. 2017.
16. Risser, F., Urosev, I., López-Morales, J. et al. Engineered Molecular Therapeutics Targeting Fibrin and the Coagulation System: a Biophysical Perspective. Biophys Rev 14, 427–461 (2022). DOI: 10.1007/s12551-022-00950-w.
17. Алипов Н. Н. Основы медицинской физиологии. Второе издание. Москва: Практика, 2012.
18. Haurowitz, Felix, Koshland, Daniel E. Keratin. Encyclopedia Britannica, 2025.
19. Li H. Mitochondria and the Future of Medicine: The Key to Understanding Disease, Chronic Illness, Aging, and Life Itself. The Yale Journal of Biology and Medicine. 2019. 92 569–570.
20. Маев И. В., Андреев Д. Н., Заборовский А. В. Фундаментальные основы кислотопродукции в желудке. Медицинский совет. 2018. 3. 7–14.
21. Струтынский А. В., Ройтберг Г. Е. Внутренние болезни. Система органов пищеварения: учеб. пособие, 6‑е изд. Москва: МЕДпресс-информ, 2021. 576 с.
22. Потехина Ю. П. Структура и функции коллагена. Нижегородская государственная медицинская академия, 2016.
23. Haurowitz, Felix, Koshland, Daniel E. Protein hormones. Encyclopedia Britannica, 2025.
24. Крюкова Е. В. Анемия хронических заболеваний. Москва: ГЭОТАР-Медиа, 2020. 160 с.
25. Protein in diet. MedlinePlus Medical Encyclopedia.
26. The Nobel Prize in Chemistry 2024. Nobelprize.org
Хотите стать востребованным специалистом с высокой зарплатой?
Откройте доступ к 5 бесплатным курсам по IT, дизайну, маркетингу и другим топовым направлениям. Определите, какая сфера вам ближе, и узнайте, как в неё попасть.
Пройти курс










